 川公网安备51010702043165
川公网安备51010702043165
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息

兴德通
近年来,医疗美容市场持续繁荣,不断涌现出新的产品。我国医疗美容器械行业市场规模呈现稳定增长的趋势,据报道,到2025年有望达到千亿级规模。在2023年上半年,许多领先的医疗美容器械上市公司在高基数的基础上实现了高增长,医疗美容领域需求旺盛,市场景气度高。在医疗美容中,常常会使用药品、医疗器械或药器组合产品。医疗美容项目可以根据是否需要手术分为手术类和非手术类(也称为轻医疗美容)两大类。手术类医疗美容项目主要指整形手术,所使用的器械是常规整形外科手术器具;非手术类(也称为轻医疗美容)项目主要包括注射类和光电类项目。由于注射类医疗美容器械具有操作简便、创伤小、治疗效果显著等特点,其在国内医疗美容领域的应用越来越广泛,市场规模也不断增长。
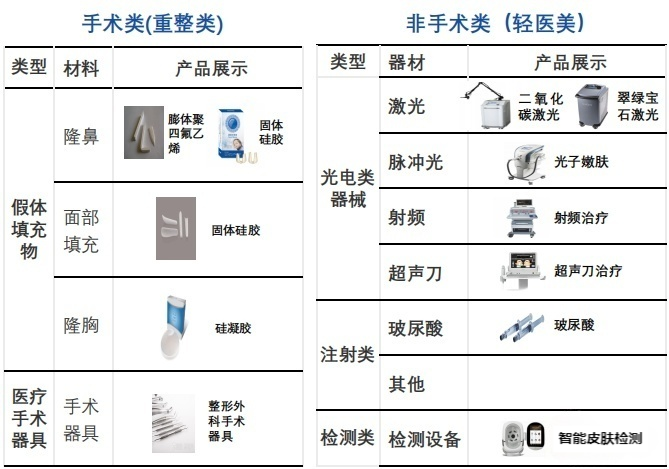
一、注射类医美器械研发上市情况
注射类医美器械主要是指整形用注射类产品,通常由注射器以及预装在注射器中的填充材料组成,用于注射到真皮层和/或皮下组织,以填充增加组织容积。
1.透明质酸钠类面部注射填充材料
透明质酸钠类面部注射填充材料是指用于面部组织注射填充以纠正皱纹的产品。这类产品主要由经过化学交联或未经化学交联的透明质酸钠与水形成的均一相凝胶或凝胶微粒混悬液组成,可能还添加了起辅助作用的药物成分,或者由不可吸收材料制成的微粒。注射用交联透明质酸钠凝胶主要适用于面部真皮组织中层至深层的注射,用于纠正中度鼻唇沟皱纹。根据国家药监局的查询,目前国内注册上市的注射用交联透明质酸钠凝胶产品共有34款,其中包括13款国产产品和21款进口产品。
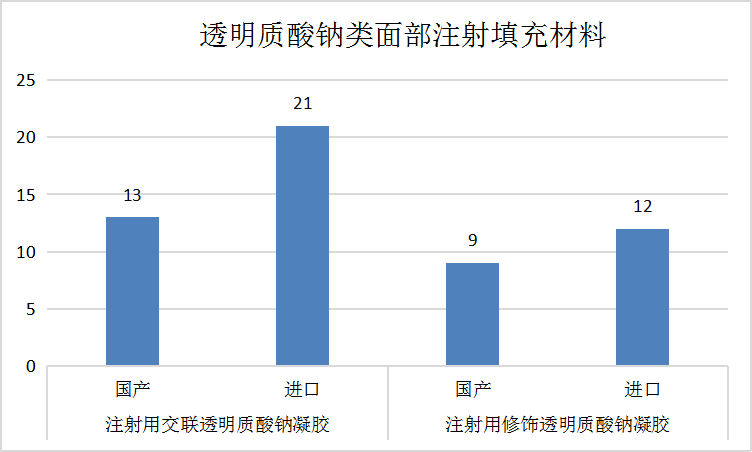
注射用修饰透明质酸钠凝胶主要适用于面部真皮组织中层至深层注射以纠正中重度鼻唇沟皱纹,用于唇红体和唇红缘的皮下(或粘膜下)注射填充唇部以达到增加唇部组织容积的目的,用于纠正静态额部皱纹,以及鼻背和/或鼻根塑形。从国家药监局查询,目前国内注册上市的注射用修饰透明质酸钠凝胶产品有21款,包括9款国产产品和12款进口产品。

据《中国玻尿酸行业发展现状分析与投资前景研究报告(2022-2029年)》,我国注射医美市场中,玻尿酸(透明质酸)和肉毒素(毒麻管制药品)的占比达到66.59%和32.67%,占比共计99.26%,透明质酸在医美市场已处于红海。
2. 胶原蛋白填充剂
胶原蛋白产品分为动物源胶原蛋白与重组胶原蛋白,在医疗美容领域,胶原蛋白被作为组织填充剂注射至面部组织内,可以起到支撑填充的作用,从而达到纠正皱纹的目的。目前国内已批准的6款胶原蛋白填充剂产品名称包括:胶原蛋白植入剂、含利多卡因胶原蛋白植入剂、医用胶原充填剂、重组Ⅲ型人源化胶原蛋白冻干纤维。
获批产品适用于纠正鼻唇沟及适用于纠正额部动力性皱纹。其中5款基于动物源性胶原蛋白,为猪胶原蛋白(3款)、牛胶原蛋白(2款)。1款为重组Ⅲ型人源化胶原蛋白冻干纤维产品。

3.透明质酸钠与羟丙基甲基纤维素复合的填充剂

4. 以可吸收聚酯类材料制成微球并填加辅料制成的填充剂
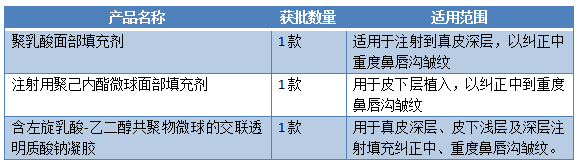
5.含不可降解成分的注射填充剂
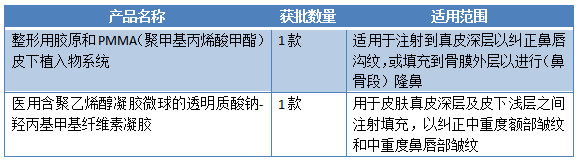
二、注射类医美器械注册申报要点
医美器械监管趋于严格,国家药监局从2020年开始陆续发布了美容器械相关注册指导原则。按照《医疗器械分类目录》,整形用注射类产品注册分类为Ⅲ类医疗器械,分类编码为13-无源植入器械-09-整形及普通外科植入物-02整形用注射填充物,主要包括注射用交联透明质酸钠凝胶、注射用透明质酸钠凝胶、胶原蛋白植入剂、注射用聚左旋乳酸填充剂、重组Ⅲ型人源化胶原蛋白冻干纤维等产品。注册申报资料应符合国家药品监督管理局《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》中对注册申报资料的要求。
透明质酸钠类面部注射填充材料注册申报应遵循《透明质酸钠类面部注射填充材料临床试验指导原则》和《透明质酸钠类面部注射填充材料注册技术审查指导原则》。若申请人以境外临床试验资料申报注册,则需按照《接受医疗器械境外临床试验数据技术指导原则》和《真实世界数据用于医疗器械临床评价技术指导原则(试行)》等要求准备注册资料。
重组人源化胶原蛋白制备的整形美容用注射材料注册申报应遵循《整形美容用重组人源化胶原蛋白注射材料技术审评要点(试行)》。申报产品的注册单元划分原则上应符合《医疗器械注册单元划分指导原则》的要求,着重考虑产品的技术原理、结构组成、性能指标及适用范围等因素。可考虑划分为不同注册单元的情况举例:(1)不同的重组人源化胶原蛋白型别。(2)不同的重组人源化胶原蛋白氨基酸序列。(3)不同的注射材料剂型,如溶液、冻干粉、凝胶等。(4)胶原蛋白结构等材料特征不同而导致产品性能指标差异较大时,建议划分为不同的注册单元。
参考资料:
1.《2023年胶原蛋白行业分析 重组胶原蛋白产品增速高》--红塔证券
2.“医美相关产品问题答疑”--国家药品监督管理局医疗器械技术审评中心
3.《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》2021
4.《医疗器械分类目录》2023年调整公告
5.《透明质酸钠类面部注射填充材料临床试验指导原则》2019
6.《透明质酸钠类面部注射填充材料注册技术审查指导原则》2016
7.《整形美容用重组人源化胶原蛋白注射材料技术审评要点(试行)》2022
8.《真实世界数据用于医疗器械临床评价技术指导原则(试行)》2020
•
•
•
•
•
•
•
•
•
•