 川公网安备51010702043165
川公网安备51010702043165
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息

易倍极医学
2023年11月17日,FDA发布了三份重要的指南文件,这些文件对医疗器械的开发和上市具有重要的指导意义。以下是对这些文件的简要解读:

图源:FDA官网
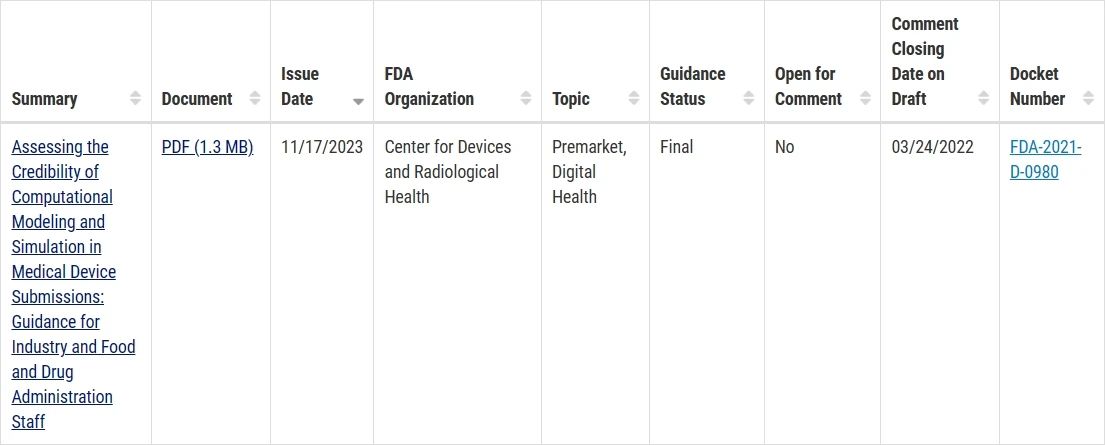
指南1:评估医疗器械提交中计算建模和仿真的可信度

图源:FDA官网
总之,该指南文件主要关注医疗器械开发和上市过程中涉及的计算建模和仿真技术的可信度评估。它明确了在医疗器械的开发和上市过程中如何评估计算建模和仿真技术的可信度和可靠性。该指南的发布将有助于确保在医疗器械的开发和上市过程中使用的计算建模和仿真技术的准确性和可靠性,并为监管部门提供更科学和合理的审查依据。
指南2:通知FDA根据FD&C法案第506J条永久停产或中断生产设备

图源:FDA官网
这则指南明确规定了制造商在决定永久停产或中断设备制造时,需及时通知FDA的流程和要求。该指南文件指出:根据第506J条,在PHE期间或之前,制造商必须提交对公共卫生至关重要的设备的通知,且至少提前6个月提交通知等……
该指南文件的发布将有助于确保医疗器械设备的质量和安全性,同时也为监管部门及时掌握市场情况提供了支持。
对于制造商而言,这不仅是遵守法规的需要,也是在日益严格的市场环境中保持竞争力的必要条件。
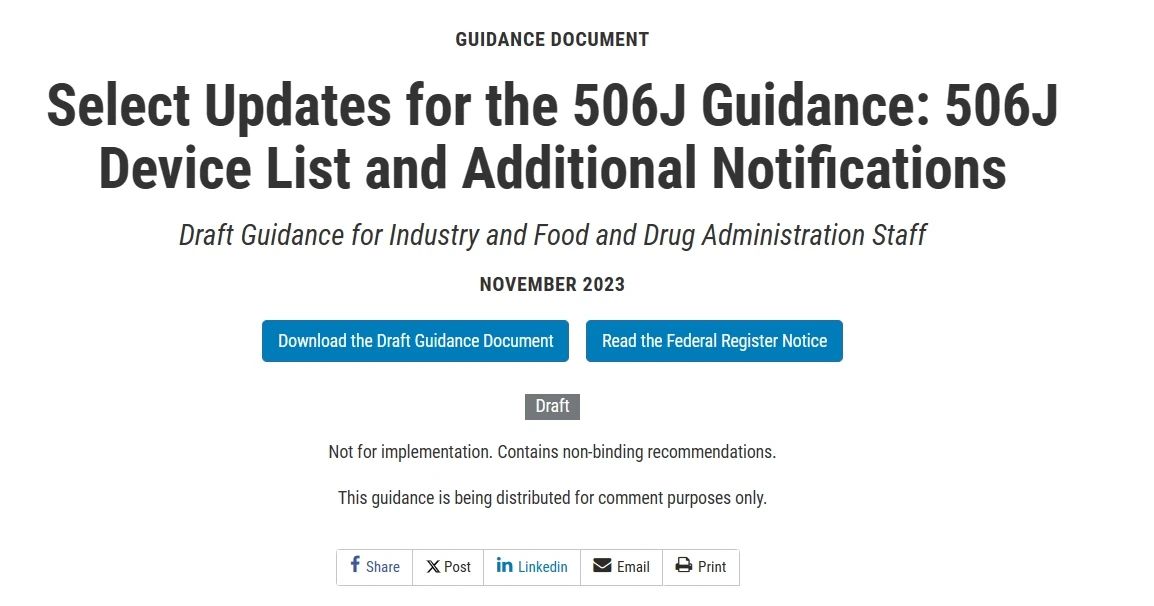
指南3:选择506J指南的更新:506J设备列表和其他通知
图源:FDA官网
●通过明确计算建模和仿真的应用范围和可信度评估方法,这些指南将推动科技创新在医疗器械领域的应用和发展。这将促进更多的科技创新,提高医疗器械的研发效率和质量,为患者提供更好的医疗服务。
•
•
•
•
•
•
•
•
•
•